横浜市立大学附属病院国際臨床肝疾患センター 米田正人センター長(同医学部肝胆膵消化器病学准教授)が参加するSYNERGY-NASH Investigatorsグループは、Metabolic dysfunction-associated steatohepatitis (MASH)
*1患者を対象に、GIP(グルコース依存性インスリン分泌刺激ポリペプチド)とGLP-1(グルカゴン様ペプチド‐1)の2つのインクレチン作用を持つチルゼパチド
*2の有効性を検討する、国際共同第2相プラセボ対照無作為化比較試験の結果を報告しました。日本で2型糖尿病治療、海外では2型糖尿病や肥満治療に使用されているチルゼパチドについて、MASH患者に対する安全性や有効性を調べるランダム化二重盲検プラセボ対照第2相試験が10カ国130施設で実施されました(SYNERGY-NASH trial)。本試験により、線維化F2/F3
*3を伴うMASH患者に対するチルゼパチドの安全性と有効性が証明されました。今後、チルゼパチド長期投与によるMASHの肝線維化の持続的改善効果等の検証など、さらなる安全性や有効性を評価する第3相試験が期待されます。
本研究成果は、「The New England Journal of Medicine」に掲載されました(2024年6月8日オンライン先行公開)。
研究成果のポイント
- 線維化F2/F3をもつMASH患者を対象としたGIP/GLP-1受容体作動薬チルゼパチドの安全性、および有効性を検討するランダム化二重盲検プラセボ対照第2相試験が実施された。
- すべての容量のチルゼパチド群で主要評価項目(線維化悪化を伴わないMASHの消失)および副次評価項目(MASHの増悪を伴わない1ステージ以上の線維化改善、NAS 2ポイント以上の改善効果)において有効性が認められた。
- チルゼパチドの主な副作用は胃腸障害であった。
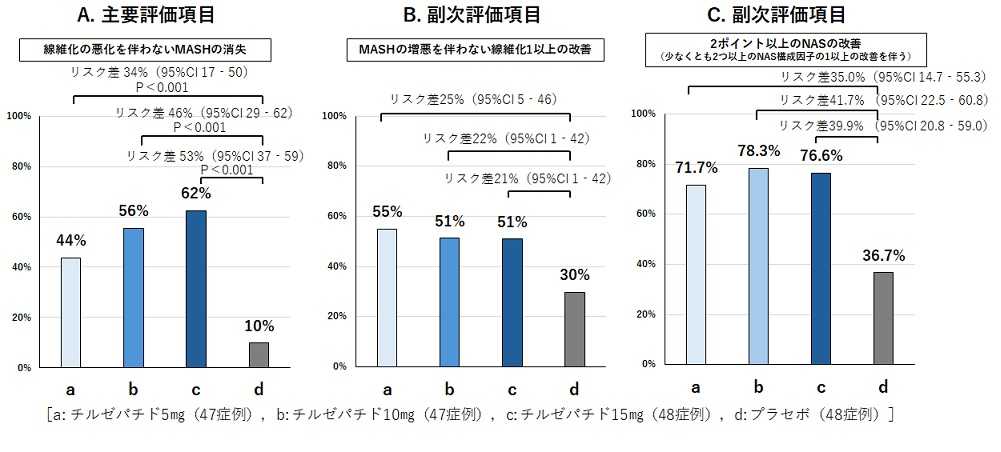
図1 国際共同第2相プラセボ対照無作為化比較試験の結果
研究内容
本試験はランダム化二重盲検プラセボ対照試験であり、10カ国130施設で実施されました。対象は生検によりMASHが確定し、BMIが27~50kg/㎡の18~80歳の患者で、2型糖尿病の有無は問いませんでした。組織学的にMASHが確定している(NAFLD activity score 4点以上、各サブコンポーネント[肝脂肪化、肝細胞の風船様変性、炎症]のスコアが1以上)、線維化F2もしくはF3の患者を対象としました。
190人のMASH患者に、チルゼパチド5mg(n=47)、10mg(n=47)、15mg(n=48)、プラセボ群(n=48)に1:1:1:1の比率でランダムに割り付けがされました。
主要評価項目である「線維化悪化を伴わないMASHの消失」は、チルゼパチド5mg、10mg、15mg群でそれぞれ44%、56%、62%(プラセボ群は10%)となり、すべての容量のチルゼパチドでプラセボ群と比べ、統計的に有意な改善効果を認めました(いずれの群もプラセボ群と比較しP<0.001)(図1A)。
副次評価項目の「MASHの増悪を伴わない線維化1ステージ以上の改善」は、チルゼパチド5mg、10mg、15mg群でそれぞれ55%、51%、51%(プラセボ群は30%)であり、すべての容量のチルゼパチドでプ改善効果を認めました(図1B)。
副次評価項目の1つである「NAS 2ポイント以上の改善(少なくとも2つ以上のNAS構成因子の1以上の改善を伴う)」は、チルゼパチド5mg、10mg、15mg群でそれぞれ71.7%、78.3%、76.6%(プラセボ群は36.7%)となり、すべての容量のチルゼパチドでプラセボ群と比べ改善効果が認められました(図1C)。
体重減少は、チルゼパチド5mg、10mg、15mg群でそれぞれ -10.7%、-13.3%、-15.6%であり、いずれの群もプラセボ群の‐0.8%と比較して減量効果が認められました。
本試験におけるチルゼパチドの主たる副作用は胃腸障害でした(表1)。
| 副作用 |
チルゼパチド群 |
プラセボ群 |
| 5mg |
10mg |
15mg |
| 嘔気 |
36.2% |
34.0% |
43.8% |
12.5% |
| 下痢 |
31.9% |
36.2% |
27.1% |
22.9% |
| 食欲低下 |
19.1% |
21.3% |
22.9% |
2.1% |
| 便秘 |
23.4% |
19.1% |
14.6% |
6.2% |
| 投与中止 |
4.2%【6例】 |
4.2%【2例】 |
表1 本試験における副作用等の状況
今後の展開
第2相臨床試験では、線維化F2/F3を伴うMASH患者に対するチルゼパチドの安全性と有効性が証明されました。今後、チルゼパチド長期投与によるMASHの肝線維化の持続的改善効果や、肝重症有害事象(major adverse liver outcomes: MALO)の抑制効果、また、MASH肝硬変患者に対する安全性や有効性を評価する第3相試験が期待されます。
研究費
本試験は、イーライリリー・アンド・カンパニーの資金提供により実施されました。
論文情報
タイトル: Tirzepatide for Metabolic Dysfunction-Associated Steatohepatitis with Liver Fibrosis
著者:Rohit Loomba、 Mark L. Hartman、 Eric J. Lawitz、 Raj Vuppalanchi、 Jérôme Boursier、 Elisabetta Bugianesi、 Masato Yoneda、 Cynthia Behling、 Oscar W Cummings、 Yuanyuan Tang、 Bram Brouwers、 Deborah A. Robins、 Amir Nikooie、 Mathijs C. Bunck、 Axel Haupt、 Arun J. Sanyal
掲載雑誌: The New England Journal of Medicine
DOI:
https://www.nejm.org/doi/full/10.1056/NEJMoa2401943
用語説明
*1 MASH:2023年6月より、NASH(非アルコール性脂肪肝炎)と呼ばれていた病態は、国際的にMASH(metabolic dysfunction-associated steatohepatitis)と病名が変更された。邦訳の正式名は現在検討中である。
*2 チルゼパチド:GIPとGLP-1の両インクレチンの作用を単一分子に統合したGIP/GLP-1受容体作動薬で、成人2型糖尿病患者の血糖値管理と長期的な体重管理のための第3相試験進行中。MASHなどに対しても臨床試験を実施中である。
*3 F2/F3:肝生検による組織評価で肝臓の線維化進展程度をF0~F4で評価する(F0:線維化なし、F1:軽度、F2:中等度、F3:重度、F4:肝硬変)。