横浜市立大学大学院医学研究科 分子生物学 佐々木和教助教、高橋秀尚教授、大野茂男特任教授らの研究グループは、上皮細胞が細胞極性を確立する過程において、タンパク質の細胞内局在の足場になるタンパク質Shank2*1が、細胞極性制御の中心的なタンパク質aPKC*2と複合体を形成し、タイトジャンクション(密着結合)と呼ばれる細胞間接着構造に局在して細胞極性形成の起点となり、低分子量Gタンパク質 Rap1*3と共役して細胞極性の形成を促進することを明らかにしました。
近年、細胞極性形成の起点となる開始複合体が細胞の形態や分化、組織構築などに必須の役割を果たし、この複合体の機能破綻が器官障害や発生不全と密接に関連していることが明らかになってきています。本研究で解明された細胞極性形成の新しい機構が、これら疾患の病態メカニズムとどのように関連しているのか、今後の進展が期待されます。
研究成果のポイント
- 新規のaPKC結合タンパク質としてShank2を同定し、Shank2がaPKCと共局在してタイトジャンクション形成に関与することを明らかにした。
- タイトジャンクション形成を制御する分子機構において、aPKC-Shank2複合体が、Rap1とともに極性プラットフォームの編成に関与することを明らかにした。
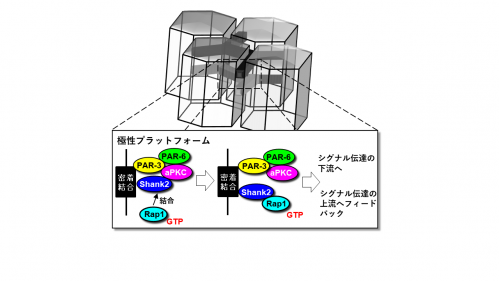
図1 細胞極性複合体によるタイトジャンクション形成の分子機構
研究の背景
上皮組織を構成する上皮細胞は、となりの細胞との間にタイトジャンクション(tight junction, 密着結合)と呼ばれる構造を発達させ接着しています。上皮細胞は、正しい場所にタイトジャンクションを形成することで、細胞膜をアピカル膜(上部の膜)とバソラテラル膜(側面及び下部の膜)に仕切り、細胞内におけるタンパク質や脂質を非対称的に分布させます。このような細胞内の不均等性のことを細胞極性と呼びます。この細胞極性が何らかの原因で崩れると、細胞の形態や分化が破綻し、組織構築をはじめとするさまざまな細胞機能に異常が生じ、器官障害や発生不全などの病態につながることが近年分かってきました。
これまでに本研究グループは、細胞極性を司るタンパク質としてatypical protein kinase C (aPKC)とその関連タンパク質の機能を解明してきました(Ohno,
Curr Opin Cell Biol 2001)。aPKCは、細胞極性に機能するタンパク質PAR-3と複合体を形成してタイトジャンクションに局在し、極性形成の起点となる重要なプラットフォームを形成します(Horikoshi, Sasaki, Ohno et al.,
J Cell Sci 2009)。そして、このaPKC-PAR-3複合体の下流においてGirdinとGαi3から構成されるシグナル伝達経路が細胞極性を正に調節すること、KIBRAと呼ばれるタンパク質がaPKCの過剰な活性化を防いでいることなどが明らかになっていました(Yoshihama, Sasaki, Ohno et al.,
Curr Biol 2011. Sasaki, Ohno et al.,
J Cell Sci 2015)。ところが、aPKCが、どのような仕組みで極性形成の起点を形成し、タイトジャンクション形成に必要な因子を呼び込むのか、詳細な分子メカニズムは不明でした。
研究の内容
近年のプロテオミクス解析やイメージング技術の進展により、aPKCを中心とした細胞極性を司るタンパク質群が細胞内の特定の領域に集積することが、細胞極性形成の重要な引き金となることが分かっていました。そこで本研究では、この細胞極性形成の起点となる開始複合体を明らかにするために、プロテオミクス解析によってaPKCに結合するタンパク質を網羅的に探索しました。そして、新規のaPKC結合タンパク質としてShank2の同定に成功しました。
Shank2にはタンパク質のドメイン(領域)構成が異なるアイソフォームの存在が知られています。興味深いことに、神経細胞ではShank2のアミノ末端領域が欠失したアイソフォームが発現しており、このアイソフォームの機能喪失は、自閉症の発症と密接に関連していることが分かっていました。一方で、上皮細胞ではアミノ末端領域を含む完全長のShank2が同定されていましたが、これが上皮細胞においてどのような役割を果たしているのか、さらに、なぜ上皮細胞のShank2はアミノ末端領域を有しているのかは不明でした。
そこで機能解析を進めたところ、Shank2は上皮細胞のタイトジャンクションにおいてaPKCと共局在することが分かりました。さらに、Shank2の欠失変異体や点変異体を用いた解析から、上皮に特有のアミノ末端領域が、Shank2をタイトジャンクションに局在化させるために必要な領域であることが判明しました。実際に上皮細胞においてShank2の機能を阻害すると、タイトジャンクション形成も阻害されることが分かりました。このように、Shank2はaPKCと細胞極性形成の起点となる開始複合体を形成し、タイトジャンクション形成を促進することが強く示唆されました。
次に、Shank2がどのようなメカニズムでタイトジャンクション形成を促進するのかを解析しました。細胞間接着に機能することが知られている低分子量Gタンパク質Rap1に着目したところ、Shank2は活性型Rap1と結合し、Rap1の下流で活性化される因子の1つAfadinをタイトジャンクション近傍に呼び寄せてタイトジャンクション形成を促進することが分かりました。
以上の結果より、Shank2はaPKCと細胞極性形成の起点となる複合体を形成し、そこでRap1-Afadinと共役してタイトジャンクションの形成を促進するという新しい分子メカニズムが明らかとなりました(図1)。
今後の展開
本研究によって、aPKC-Shank2複合体によるタイトジャンクション形成の新しいメカニズムが明らかになりました。上皮細胞において細胞極性の形成機構が破綻すると、上皮細胞の生理的機能が異常となり、器官障害をはじめとするさまざまな病態を引き起こします。例えば、腎臓の糸球体には、スリット膜と呼ばれる特殊な細胞間接着装置があり、血液をろ過して尿を産生する際に重要な働きをしています。この機能に障害が起きると、ネフローゼ症候群(蛋白尿)などの腎機能障害が引き起こされます。ノックアウトマウスを用いた遺伝学的な解析から、aPKC、Shank2、Rap1遺伝子がそれぞれ破壊されると、糸球体のスリット膜の機能不全によって、腎臓のろ過機能に障害が起こり、ネフローゼ症候群の一つである巣状糸球体硬化症様の腎障害が引き起こされることが知られています。本研究で明らかとなったaPKC-Shank2複合体が、巣状糸球体硬化症をはじめ疾患の発症メカニズムに関与していることが明らかとなれば、これら複合体を標的とした治療や創薬への応用が期待されます。
用語の説明
*1 Shank2 (SH3 and multiple ankyrin repeat domains 2)
Shankタンパク質ファミリーに属し、タンパク質間相互作用に関与するSPN, Ankyrin repeats, SH3, PDZ, Proline rich, SAMなどの機能ドメインから構成される足場タンパク質で、タンパク質の複合体形成や局在化に重要な役割を果たします。
*2 aPKC (atypical protein kinase C)
プロテインキナーゼCファミリーに属するリン酸化酵素で、細胞極性タンパク質と共に複合体を形成し、頂底極性や前後軸極性といったさまざまな細胞極性において中心的な役割を果たします。
*3 Rap1 (Ras-related protein 1)
Rasタンパク質ファミリーに属する低分子量Gタンパク質で、GTPが結合した活性状態とGDPが結合した不活性状態を遷移することで、細胞内シグナル伝達のオンとオフをスイッチする分子として機能します。
※本研究は、米国の科学雑誌『Cell Reports』に掲載されます。(米国東部時間4月7日午前11時付:日本時間4月8日午前0時付)
掲載論文
Shank2 binds to aPKC and controls tight junction formation with Rap1 signaling during establishment of epithelial cell polarity
Kazunori Sasaki*, Noriko Kojitani, Hiroko Hirose, Yohei Yoshihama, Hidefumi Suzuki, Miho Shimada,
Ayumi Takayanagi, Akio Yamashita, Masa-aki Nakaya, Hisashi Hirano, Hidehisa Takahashi*, Shigeo Ohno* (* Correspondence)
Cell Reports, April 7, 2020
https://doi.org/10.1016/j.celrep.2020.02.088
※本研究は、文部科学省科学研究費補助金、公益財団法人MSD 生命科学財団、公益財団法人内藤記念科学振興財団、公益財団法人上原記念生命科学財団、公益財団法人横浜学術教育振興財団の研究補助金により行われました。