藤田医科大学医学部ウイルス・寄生虫学の村田貴之教授、名古屋大学トランスフォーマティブ生命分子研究所の藤本和宏特任准教授、大松亨介特任准教授、佐藤綾人特任准教授、名古屋大学大学院医学系研究科の佐藤好隆講師らの研究グループは、TMPRSS2※1阻害剤であるナファモスタット※2とその類縁体の作用メカニズムを解析。ナファモスタットおよび類縁体とTMPRSS2の直接相互作用が、抗ウイルス活性に重要であることを明らかにするとともに、SARS-CoV-2(新型コロナウイルス)に対してナファモスタットと同等あるいはそれ以上に効果のある化合物を世界に先駆けて同定しました。
本研究成果は、ウイルス学専門誌「Viruses」2月14日の電子版に掲載されました。
論文URL :
https://www.mdpi.com/1999-4915/14/2/389
<研究成果のポイント>
- ナファモスタットあるいはその類縁体とTMPRSS2の直接相互作用が抗ウイルス活性に重要であることを示しました。
- SARS-CoV-2に対してナファモスタットと同等あるいはそれ以上の効果のある化合物を世界に先駆けて同定しました。
<研究の目的>
SARS-CoV-2は伝播性が高く、特に高年齢層や基礎疾患のある人においては重篤化、死亡のリスクが高いため、世界的な公衆衛生上の問題となっています。このため、ワクチン接種と並んで抗ウイルス薬の開発が重要な課題となっています。
SARS-CoV-2は細胞に感染するとき、ウイルスのスパイク(S)タンパク質が細胞表面にあるACE2というタンパク質を認識して結合し、さらにTMPRSS2という細胞のプロテアーゼ※3によってSタンパク質が切断されることで効率よく細胞内に侵入します。このためTMPRSS2の活性を阻害するナファモスタットは、SARS-CoV-2の感染を阻害することが知られています(Yamamoto et al., Viruses 2020ほか)。
今回、研究グループは、ナファモスタットおよびその類縁体とTMPRSS2の立体構造データをもとに、その親和性について計算科学的解析を行い、さらにナファモスタットと同程度の結合力を有すると推測された誘導体を実際に合成し、それらの抗ウイルス効果を評価しました。
<研究手法と材料>
TMPRSS2阻害剤であるナファモスタットとその類縁体の作用メカニズムの解析は以下のように行いました。TMPRSS2の結晶構造はProtein Data Bank (PDB)より取得しました。化合物とTMPRSS2の結合シミュレーションは、fitness learning-based artificial bee colony with proximity stimuli(FlABCps)法、およびGlide法により行いました。分子間相互作用エネルギーは、量子化学の計算手法である2次のMøller–Plesset摂動法(MP2)により計算しました。
ナファモスタットとその類縁体におけるSARS-CoV-2のウイルス感染阻害効果は、以下の2つの条件で評価しました。
(条件1)感染1時間前から細胞を阻害薬で処理し、ウイルスをMOI※4=0.01で感染させました。30分後ウイルス液を除き、新しい培養液と交換しました。さらに翌日、翌々日に培養液交換を行い、5日目にCPE※5の有無を観察しました。感染1時間前からCPE観察まで常に阻害薬を添加していました。
(条件2)同様に処理しましたが、ウイルス感染後1度も培養液を交換しませんでした。
阻害剤の濃度を10倍段階希釈し、それぞれの濃度で12ウェルの試行を行い、そのうちいくつのウェルでCPEが観察されたか観察しました。そのデータを4係数ロジスティック曲線によって近似し、50%阻害濃度を計算しました。
Calu-3、Vero、VeroE6/TMPRSS2細胞は、Japanese Collection of Research Bioresources Cell Bank(JCRB)より入手しました。ウイルスは、神奈川県衛生研究所より譲渡を受けたSARS-CoV-2をVero細胞で増幅し、実験に供しました。
<研究成果>
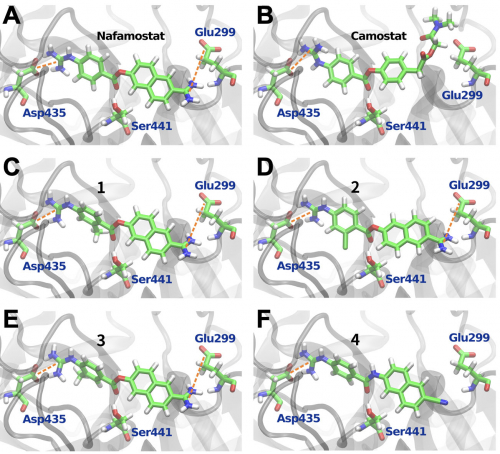
ナファモスタットはTMPRSS2の活性中心で加水分解※6され、その分解産物がSer441とアシル結合※7することで恒常的にプロテアーゼ活性を阻害するとされています(Fraser et al., bioRxiv 2021ほか)。本研究では、そのアシル結合だけでなく、加水分解前のナファモスタット(あるいはその類縁体)とTMPRSS2の親和性が、阻害に重要であることが示されました。特にTMPRSS2のAsp435とGlu299の2つの残基は、ナファモスタットやその類縁体との結合に極めて重要であることが示唆されました(図)。
図の説明:TMPRSS2と化合物の結合シミュレーションの結果。ナファモスタット(A)および類縁体1(C)、2(D)、3(E)は、Glu299とAsp435との相互作用を介してTMPRSS2活性中心に結合することが強く示唆された。一方、カモスタット(B)や類縁体4(F)はGlu299との相互作用が弱いことが予想され、実際に抗ウイルス効果も低かった。
実際、TMPRSS2の活性中心と計算上親和性が高い化合物は、概ね抗ウイルス効果が高い傾向にありました。さらに今回研究グループが検討した5つの類縁体のうち3つは、ナファモスタットと同等あるいは若干ではあるもののナファモスタットを上回る抗ウイルス活性を示しました。
抗ウイルス活性のアッセイにおいて、培養液交換をしない場合(条件2)においては、交換した場合(条件1)に比べて抗ウイルス活性が大きく減弱していました。このことは、(i)30分で細胞に吸着しなかったウイルスがその後感染した、(ii)ナファモスタットやその類縁体は分解されやすく、頻繁に供給することでより高い効果が得られた、の可能性が考えられました。実際ナファモスタットは体内での分解が早いことが知られているため、(ii)の寄与も少なくないと考えられました。
<考察>
本研究では、ナファモスタットあるいはその類縁体とTMPRSS2の相互作用が抗ウイルス活性に重要であることを明らかにしました。さらに、SARS-CoV-2に対してナファモスタットと同等あるいはそれ以上の効果のある化合物を世界に先駆けて同定しました。
Sタンパク質のTMPRSS2切断部位周辺のアミノ酸配列は既知の変異株で高度に保存されており、ナファモスタットやその類縁体はオミクロン株を含む変異株にも効果があることが推測されます。
<用語解説>
※1 TMPRSS2
transmembrane protease serine 2の略。呼吸器系上皮細胞の細胞膜上に存在する宿主のセリンプロテアーゼ。SARS-CoV-2の細胞への侵入を促進する。
※2 ナファモスタット
膵炎や汎発性血管内血液凝固症の薬として使用されている、本邦で開発されたセリンプロテアーゼ阻害剤。新型コロナウイルスの治療薬として有効であると考えられ、臨床研究が進められている。
※3 プロテアーゼ
ペプチド結合を加水分解することで標的タンパク質の切断、分解を促進する酵素の総称。
※4 MOI
multiplicity of infectionの略で、1細胞あたりに感染するウイルス数の指標。MOI=0.01だと、100個の細胞につき1個のウイルスを感染させている。
※5 CPE
cytopathic effectの略。ウイルスが細胞に感染することで起こる細胞の形態変化のこと。日本語では細胞変性効果という。
※6 加水分解
化合物に水が反応することによって生じる分解反応のこと。ナファモスタットの場合は4-guanidinobenzoic acid (GBA)と6-amidino-2-naphtholに分解される。
※7 アシル結合
ヒドロキシル基(-OH)などの水素原子をアシル基(-CO-R)で置換する反応によって生じる結合。TMPRSS2のSer441にナファモスタットの分解産物であるGBAがアシル結合し、安定的に共有結合する。
<文献情報>
発表雑誌:Viruses 2022, 14(2), 389
論文タイトル:In silico Analysis and Synthesis of Nafamostat Derivatives and Evaluation of Their Anti-SARS-CoV-2 Activity
著者:藤本和宏1,2*、Daniel C. F. Hobbs2, 梅田実希3、永田晃大1,4、山口理恵1,4、佐藤好隆3,5、佐藤綾人1、大松亨介1,4、大井貴史1,4、柳井毅1,2, 木村宏3、村田貴之3,6*
所属: 1 名古屋大学 トランスフォーマティブ生命分子研究所
2 名古屋大学大学院 理学研究科 物質理学専攻
3 名古屋大学大学院 医学系研究科 ウイルス学
4 名古屋大学大学院 工学研究科 有機・高分子化学専攻
5 JSTさきがけ
6 藤田医科大学 医学部 ウイルス・寄生虫学
DOI:10.3390/v14020389