~末梢-中枢連関に注目した認知症の新規予防・治療薬の開発に期待~
藤田医科大学 大学院保健学研究科レギュラトリーサイエンス分野 大学院生 窪田悠力(現:精神・神経病態解明センター 助教)と毛利彰宏教授、同保健学研究科の齋藤邦明教授と鍋島俊隆客員教授、京都大学 大学院医学研究科創薬医学講座の成宮周教授らの研究グループは、食塩過剰摂取に起因する認知症の新たな発症メカニズムを解明しました。
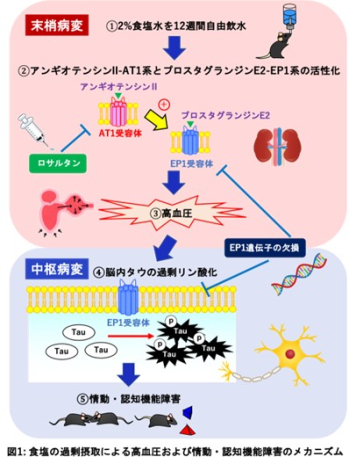
食塩の過剰摂取は、高血圧や認知機能障害に密接に関与していることから認知症のリスク因子として考えられています。しかしながら、高血圧と認知症の関連性の基盤となるメカニズムは分かっておらず、末梢と中枢の相互作用(末梢-中枢連関※1)に注目した検討は十分にされていませんでした。同研究グループはアンギオテンシンII-AT1系※2とプロスタグランジンE2-EP1系※3のクロストークを介する高血圧が、アルツハイマー型認知症の病態に関連するタウ※4の過剰リン酸化を伴う情動・認知機能障害を引き起こすことを明らかにしました。
本研究成果により、アンギオテンシンII-AT1系とプロスタグランジンE2-EP1系を標的とした認知症の新しい予防・治療薬の開発につながることが期待されます。
本研究成果は、国際学術誌「British Journal of Pharmacology」の掲載に先駆け、オンライン版が2023年4月19日に公開されました。
掲載URL:
https://bpspubs.onlinelibrary.wiley.com/doi/10.1111/bph.16093
<研究成果のポイント>
マウスを用いた実験で、血液脳関門※5を通過しないアンギオテンシンII受容体拮抗薬のロサルタンの投与により、食塩の過剰摂取による高血圧だけでなく中枢病変とするタウの過剰リン酸化および情動・認知機能障害を改善させました。
ロサルタンの投与により、食塩の過剰摂取による血漿プロスタグランジンE2の産生を抑えました。
プロスタグランジンE2受容体の1つであるEP1の遺伝子欠損マウスでは、食塩の過剰摂取による高血圧、タウの過剰リン酸化および情動・認知機能障害が認められませんでした。
アンギオテンシンII-AT1系とプロスタグランジンE2-EP1系を標的とした認知症の新しい予防・治療薬の開発が期待されます。
<背 景>
日本の65歳以上の認知症有病率は15%と非常に高く、認知症に対する社会的費用は2014年において年間約 14.5 兆円に上ることが報告されており、2060年には24兆3,000 億円に達することが推計されています。現時点での認知症の治療満足度・薬剤貢献度は他の疾患に比べ最低ラインに位置しており、根治できる薬物療法は存在しません。急速な高齢化が進む日本において、認知症に対する予防・治療薬を開発することは喫緊の課題と考えられています。認知症の発症には遺伝的要因だけでなく、生活習慣などの環境的要因も関わっており、高血圧、糖尿病、脂質異常症などの生活習慣病が認知症の発症脆弱性の形成に寄与する可能性が示唆されています。WHOが示している食塩摂取量の目標値が5g/日未満に対して日本人の摂取量は約2倍であり、特に高血圧と認知症の関連が注目されています。実際に、食塩の過剰摂取は高血圧を誘発し(Takase H, et al. J Am Heart Assoc, 2015)、高血圧は血管性認知症の発症リスクを高めます(Ninomiya T, et al. Hypertension, 2011)。また、食塩の過剰摂取はアルツハイマー型認知症の病態に関連するタウの過剰リン酸化を伴った認知機能障害を引き起こします(Faraco G, et al. Nature, 2019)。しかし、生活習慣による身体機能の変化がどのように中枢機能に影響を及ぼして、認知症の発症・病態悪化を引き起こすのか、末梢-中枢での相互作用(末梢-中枢連関)に注目した検討は十分にされていません。
<研究手法・研究成果>
本研究では、マウスに食塩を過剰摂取させた高血圧モデルを使用しました。本モデルマウスにおいて、血圧調節に重要なアンギオテンシンII-AT1系とプロスタグランジンE2-EP1系の活性化を伴う血圧が認められました。行動学的解析において、社会性行動※6および物体認知記憶※7の低下といった情動・認知機能障害が認められました。脳内においてはアルツハイマー型認知症の病態に関連するタウの過剰リン酸化が認められました。血液脳関門を通過しないアンギオテンシンII受容体拮抗薬のロサルタンを本モデルマウスに持続的投与したところ、高血圧だけでなくタウの過剰リン酸化および行動異常も抑えたことから、末梢における変化が中枢神経系に影響を与えている末梢-中枢連関が示唆されました。また、ロサルタンは本モデルマウスにおける血漿プロスタグランジンE2の産生を抑えたことから、アンギオテンシンII-AT1系とプロスタグランジンE2-EP1系のクロストークを見出しました。さらにEP1遺伝子欠損マウスに食塩を過剰摂取させた結果、高血圧、タウの過剰リン酸化および行動異常は認められませんでした。以上のことから、食塩の過剰摂取は高血圧および情動・認知機能障害を引き起こし、そのメカニズムとしてアンギオテンシンII-AT1系とプロスタグランジンE2-EP1系が関与していることが明らかになりました(図1)。
<今後の展開>
認知症をはじめ多くの精神疾患で生活習慣病などの末梢臓器の異常を伴うことが知られていますが、これまで中枢のみに焦点を当てた研究が殆どであり、末梢-中枢連関についての検討は十分にされていませんでした。本研究により、アンギオテンシンII-AT1系とプロスタグランジンE2-EP1系のクロストークを介する高血圧が、食塩の過剰摂取による情動・認知機能障害を引き起こすことが明らかになりました。本研究に用いたロサルタンは既に安全性が確認されており、臨床では高血圧患者に対して使用されています。すなわちドラッグリポジショニング※8により、今回新たに見つかったロサルタンにおける認知症の予防効果については早期に臨床応用が可能であると考えられます。一方、アラキドン酸より生成されるプロスタノイドには様々なプロスタグランジンやトロンボキサンがあり、それぞれ特異的な受容体を介して異なる作用を示します。そのため、プロスタノイドに着目した創薬研究は副作用を惹起させないためにも各受容体への影響を考慮する必要があります。本研究により、プロスタグランジンE2-EP1系が高血圧およびタウの過剰リン酸化に関わることが明らかになったことから、EP1を標的とした選択的な阻害剤が認知症の新規予防・治療薬として期待されます。
<用語解説>
※1 末梢-中枢連関
身体(末梢臓器)と中枢(脳)がお互いに影響を及ぼしあうこと。
※2アンギオテンシンII-AT1系
アンギオテンシンIIは強力な末梢血管収縮作用を持つ生理活性物質である。AT1受容体に作用すると血管収縮を引き起こす。
※3 プロスタグランジンE2-EP1系
プロスタグランジンE2はアラキドン酸より生合成される生理活性物質である。EP1〜EP4の4つの受容体があり、その中でもEP1に作用すると血管収縮を引き起こす。
※4 タウ
神経細胞に豊富に存在し、神経細胞の形態維持や物質輸送に働くタンパク質。過剰にリン酸化された病的なタウの蓄積は神経細胞死を引き起こす。アルツハイマー型認知症患者の脳内において病的タウの蓄積が観察されている。
※5 血液脳関門
脳と循環血液の間に存在するバリアであり、脳内への物質の輸送を制限する機能を持つ。これにより脳内に必要な栄養素を取り入れつつ、細菌やウイルスなどの有害物質の脳内への侵入を防ぎ、脳を保護する働きがある。薬剤もその性質上、血液脳関門を通過するものとそうでないものがある。
※6 社会性行動
ヒトにおいて社会的コミュニケーションを指す。マウスでは社会性行動試験により測定される。マウスは他のマウスに対して匂いを嗅ぐ、追いかける、上に乗りかかる、下に潜るなどの社会性行動をする。
※7 物体認知記憶
ヒトにおいて視覚的認知記憶を指す。マウスでは新奇物体認知試験により測定される。マウスは新奇性を好むという性質があり、既に記憶している物体よりも未知の物体を見つけると近づいて探索行動をとる。
※8 ドラッグリポジショニング
ヒトにおいて安全性と体内動態が確認されている既存薬から新たな薬効を見出し、別の疾患の治療薬として開発する手法のこと。
<文献情報>
論文タイトル
High salt induces cognitive impairment via the interaction of angiotensin II-AT1 and prostaglandin E2-EP1 systems
著者
1窪田悠力、1國澤和生、2ウラルボラテ、1長谷川眞也、1倉橋仁美、1坂田昂駿、4手塚裕之、5釘田雅則、5長尾静子、6永井拓、7古屋敷智之、8成宮周、2, 3齋藤邦明、2鍋島俊隆、1毛利彰宏
所属
1藤田医科大学 大学院保健学研究科 レギュラトリーサイエンス分野
2藤田医科大学 大学院保健学研究科 先進診断システム探索研究部門
3藤田医科大学 大学院保健学研究科 先進診断システム探索開発分野
4藤田医科大学 オープンファシリティセンター 細胞機能解析室
5藤田医科大学 病態モデル先端医学研究センター
6藤田医科大学 精神・神経病態解明センター 神経行動薬理学研究部門
7神戸大学 大学院医学研究科 薬理学分野
8京都大学 大学院医学研究科 創薬医学講座
DOI
10.1111/bph.16093