横浜市立大学大学院医学研究科 生理学の高橋琢哉教授と波多野真依助教らの研究グループは、新規開発されたAMPA受容体
*1を標識するPET用トレーサー
*2([11C]K-2)を用いて、うつ病、自閉症スペクトラム障害(ASD)、統合失調症、双極性障害の患者149名と健常者70名を対象に大規模なPET撮像を実施し、精神疾患患者の脳内における神経伝達に重要な役割を果たすAMPA受容体の分布を可視化・定量化しました。
その結果、疾患ごとに特徴的なAMPA受容体の分布が確認され、一方で、疾患に共通してAMPA受容体に変化が見られる脳領域も特定しました。異なる疾患にも関わらず共通して存在するAMPA受容体異常の発見は新しい知見であり、精神疾患の生物学的メカニズムの理解を深め、新たな診断・治療法の開発に貢献することが期待されます。
本研究成果は、「Molecular Psychiatry」に掲載されました(2024年10月15日)。
研究成果のポイント
- 精神疾患患者149名と健常者70名について、[11C]K-2を用いて、脳内の興奮性神経伝達を担うAMPA受容体を可視化した大規模研究
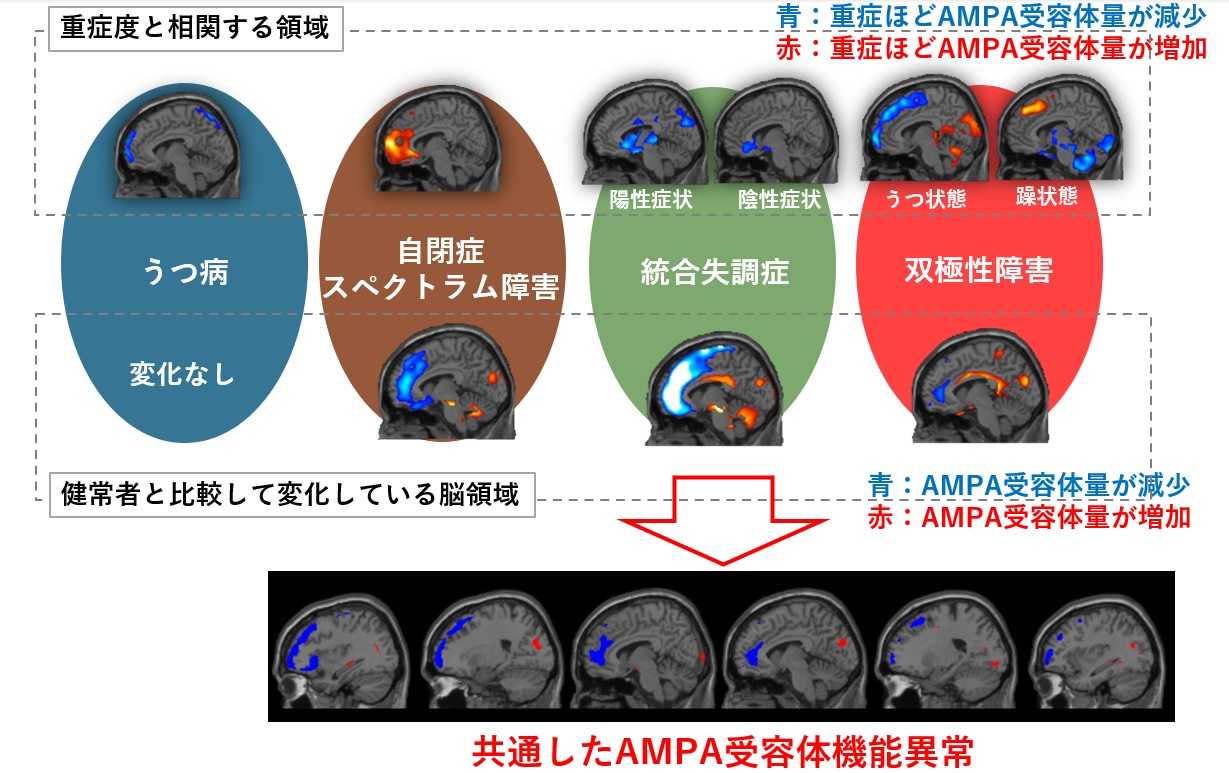
- 重症度に伴ってAMPA受容体の量が変化する脳領域を4つの疾患それぞれで解明
- うつ病以外の3つの精神疾患は共通した脳領域でAMPA受容体量の異常を有することを解明
うつ病、自閉症スペクトラム障害(ASD)、統合失調症、双極性障害などの精神疾患は生活の質の低下を伴い、大きな社会的損失を招きます。精神疾患の原因は、動物実験を用いた基礎研究から一部が明らかになってきました。しかし、実際の精神疾患患者における知見は、技術的な制約により限られており、精神疾患の病態を明解に表現する客観的指標の開発が期待されています。
精神疾患は「シナプス
*3病」と表現されるように、シナプスの機能不全が精神疾患の原因となっている可能性が示されています。AMPA受容体は神経の細胞と細胞の間をつなぐ「シナプス」に存在しており、脳内の主要な情報伝達を担い、記憶や学習に深く関与することが知られています。本研究グループでは、生きたヒトの脳における細胞表面のAMPA受容体を可視化・定量化する世界初の新規放射性トレーサー化合物:[11C]K-2を開発しました(Miyazaki et al., 2020, Arisawa et al., 2021.)。本研究では、[11C]K-2を用いて、精神疾患(うつ病、ASD、統合失調症、双極性障害)のPET撮像を行い、脳内のAMPA受容体分布の可視化を目指しました。
研究内容
本研究は、うつ病、ASD、統合失調症、双極性障害の患者149名において、AMPA受容体を標識するPETトレーサー([11C]K-2)を用いた撮像を行いました。疾患ごとに精神症状の重症度スコアとAMPA受容体密度との相関解析や、健常者画像との比較解析を行うことで、精神疾患の生物学的メカニズムの解明を目的としました。
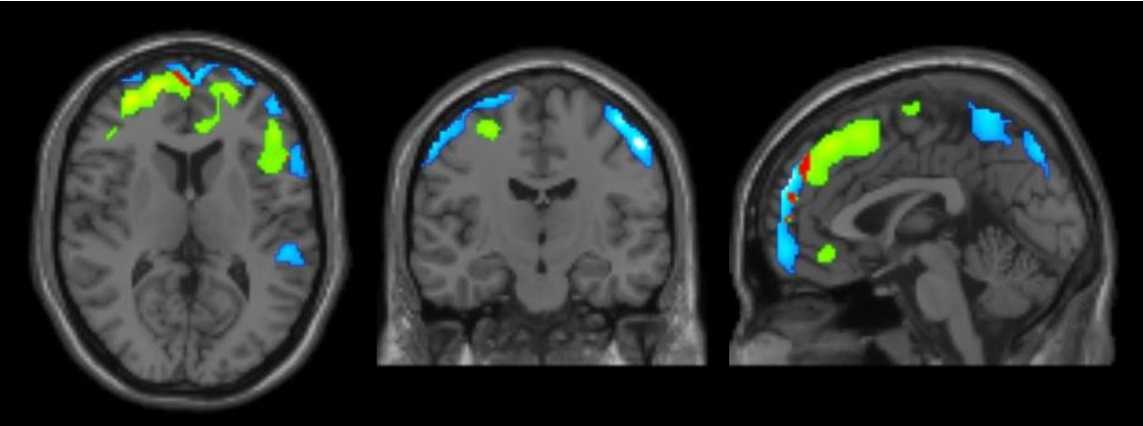
相関解析では、うつ病において、うつ症状の重症度スコアとAMPA受容体密度間には有意な負の相関が前頭葉を中心とした領域に認められました(図1、重症度と相関する脳領域:うつ病)。双極性障害においては、興味深いことに、うつ症状とAMPA受容体密度間には前頭葉で負の相関、小脳で正の相関が見られました[図1、重症度と相関する脳領域:双極性障害(うつ状態)]。一方で、躁症状とAMPA受容体密度間には、前頭葉で正の相関、小脳で負の相関が見られており、うつ症状と躁症状は相補的な関係にあることが明らかになりました[図1、重症度と相関する脳領域:双極性障害(躁状態)]。また、うつ病と双極性障害のうつ症状を規定する脳領域がほとんど重複しないことから、これらの疾患は同じうつ症状でも生物学的には異なった症状であることが示唆されました(図2)。
統合失調症においては、陽性症状および陰性症状とAMPA受容体密度間には負の相関が前部帯状回膝前部・膝下部に認められました(図1、重症度と相関する脳領域:統合失調症)。ASDにおいては、自閉症症状とAMPA受容体密度間に正の相関が眼窩回領域を中心に認められました(図1、重症度と相関する脳領域:ASD)。これらのことから、各疾患の重症度に伴って、AMPA受容体密度が変化する脳領域を同定することに成功しました。
図2 うつ病と双極性障害におけるうつ症状とAMPA受容体密度の負の相関領域
(青:うつ病における相関領域、緑:双極性障害における相関領域、赤:二疾患の共通領域)
健常者との比較解析では、ASD、統合失調症、双極性障害において、AMPA受容体密度が有意に変化している脳領域が認められました(図1、健常者と比較して変化している領域)。一方、うつ病患者では変化が認めらなかったことから、他の3疾患と比べて健常者と連続性がある可能性が示唆されました。また、興味深いことに、上記3疾患では、共通した変化が見られており、前部帯状回や島皮質ではAMPA受容体密度の低下、後頭葉ではAMPA受容体密度の増加が認められました(図3)。これらの共通した変化は、上記症状との相関領域とはほとんど重複しておらず、精神疾患の基質を形成している可能性があります。
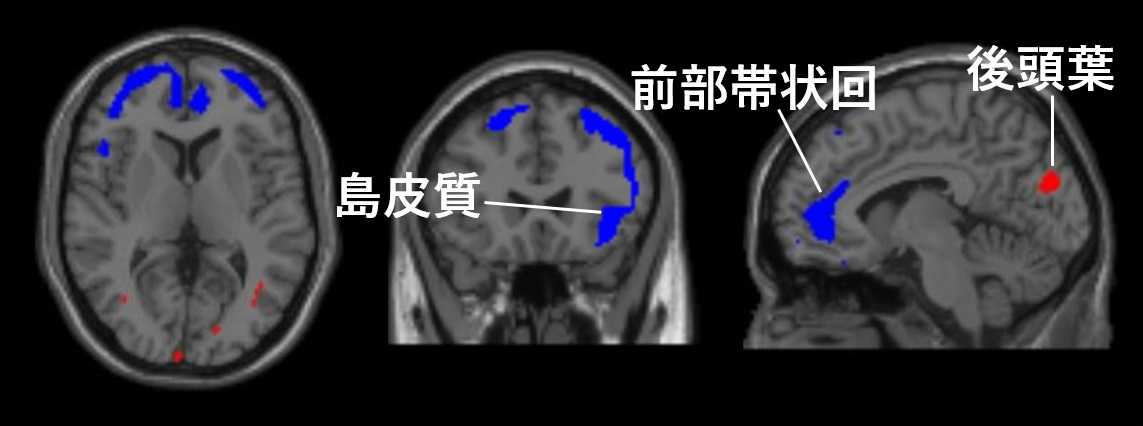 図3 ASD、統合失調症、双極性障害におけるAMPA受容体密度の共通変化領域(青:低下領域、赤:増加領域)
図3 ASD、統合失調症、双極性障害におけるAMPA受容体密度の共通変化領域(青:低下領域、赤:増加領域)
本研究では、各疾患における症状との相関領域や精神疾患共通の基質になりうる脳領域を特定しました。本研究グループは、基質領域が形成された後になんらかのストレスが加わることで症状を担う領域に変化が起こり、精神疾患を発症すると仮説を立てています。今後は、動物実験や、同じ患者を長期間追跡する研究(縦断的研究)を通じて、精神疾患の起源や形成過程・メカニズムを明らかにしていく必要があります。
また、AMPA PETを用いたアプローチによって、脳内の神経活動に基づいた新しい診断法や治療法を開発する道を開く可能性があります。具体的な試みの一つとして、現在、本研究グループではうつ病と双極性障害の鑑別法の開発を進めています。
研究費
本研究は、文部科学省「イノベーションシステム整備事業 先端融合領域イノベーション創出拠点形成プログラム」(No.42890001)、国立研究開発法人日本医療研究開発機構(AMED)脳科学研究戦略推進プログラム・臨床と基礎研究の連携強化による精神・神経疾患の克服(融合脳)「AMPA受容体標識PETプローブを用いた精神神経疾患横断的新規診断治療法の開発(研究代表者:高橋琢哉)」、脳神経科学統合プログラム(脳統合)「AMPA受容体PETイメージングに基づいた認知症病態回路の解明(研究代表者:高橋琢哉)」、脳神経科学統合プログラム(脳統合)「数理と臨床の共創による精神疾患サブタイプのヒト病態メカニズム解明(研究代表者:平野羊嗣)」、脳と心の研究推進プログラム・革新的技術による脳機能ネットワークの全容解明プロジェクト(革新脳)「脳血管障害とパーキンソン病における脳神経障害とその機能回復に関わるトランスレータブル脳・行動指標の開発」、「神経変性疾患のタンパク凝集・伝播病態と回路障害の分子イメージング研究」、JSPS科研費(20H00549, JP20H05922, 19H03587, 20K20603, 22H03001, 22K15793, 20KK0193, 21H02851)、武田科学財団助成金、慶應義塾次世代研究プロジェクト推進プログラム、公益財団法人先進医薬研究振興財団、公益財団法人臨床薬理研究振興財団の支援を受けて実施されました。
論文情報
タイトル:Characterization of patients with major psychiatric disorders with AMPA receptor positron emission tomography
著者:Mai Hatano, Waki Nakajima, Hideaki Tani, Hiroyuki Uchida, Tomoyuki Miyazaki, Tetsu Arisawa, Yuuki Takada, Sakiko Tsugawa, Akane Sano, Kotaro Nakano, Tsuyoshi Eiro, Hiroki Abe, Akira Suda, Takeshi Asami, Akitoyo Hishimoto, Nobuhiro Nagai, Teruki Koizumi, Shinichiro Nakajima, Shunya Kurokawa, Yohei Ohtani, Kie Takahashi, Yuhei Kikuchi, Taisuke Yatomi, Shiori Honda, Masahiro Jinzaki, Yoji Hirano, Ryo Mitoma, Shunsuke Tamura, Shingo Baba, Osamu Togao, Hirotaka Kosaka, Hidehiko Okazawa, Yuichi Kimura, Masaru Mimura and Takuya Takahashi
掲載雑誌:Molecular Psychiatry
DOI:
https://doi.org/10.1038/s41380-024-02785-1
共同研究者
慶應義塾大学 医学部 精神・神経科学教室 内田裕之 教授
宮崎大学 臨床神経科学講座 精神医学分野(研究当時:九州大学) 平野羊嗣 准教授
福井大学 医学系部門 医学領域 病態制御医学講座 精神医学 小坂浩隆 教授
福井大学 先進部門 高エネルギー医学研究センター長 岡沢秀彦 教授
他
用語説明
*1 AMPA受容体:脳の働きを担う主役である分子で、脳内の情報処理の中心的な役割を担う神経伝達物質であるグルタミン酸の受容体の一つであり、シナプス膜上にイオンチャネルを形成する。グルタミン酸がAMPA受容体に結合すると、細胞内にイオンが流入しシナプスが応答するため、シナプス膜上のAMPA受容体の数が増えるとさらに応答が増強し、シナプス応答の変化は、記憶学習をはじめとした脳内の情報処理の変化における中心的なメカニズムであることが知られている。
*2 PET用トレーサー:陽電子検出を利用したコンピューター断層撮影技術が陽電子断層撮影(PET:Positron Emission Tomography)で、この技術を使うと、放射性ラベルした化合物を検出することができる。AMPA受容体に特異的に結合する化合物を放射性ラベルし(PET用薬剤)、PETを用いて撮像することにより、AMPA受容体の量をヒト生体脳で定量化できる。
*3 シナプス:神経細胞同士をつなぎ神経細胞間の情報伝達の中心を担う構造体で、神経細胞が活性化すると、その神経細胞のシナプス前末端から放出された神経伝達物質が別の神経細胞のシナプスにある受容体に結合することで情報が伝わる。
参考文献
Miyazaki T, Nakajima W, Hatano M, Shibata Y, Kuroki Y, Arisawa T et al. Visualization of AMPA receptors in living human brain with positron emission tomography. Nature Medicine 2020; 26(2): 281-288.
https://doi.org/10.1038/s41591-019-0723-9
Arisawa T, Miyazaki T, Ota W, Sano A, Suyama K, Takada Y et al. [11C]K-2 image with positron emission tomography represents cell surface AMPA receptors. Neurosci Res 2021
https://doi.org/10.1016/j.neures.2021.05.009