横浜市立大学大学院生命医科学研究科 構造生物学研究室 有田恭平 准教授、郡 聡実(博士後期課程2年)、治面地智宏(2017年度博士前期課程修了)、生命情報科学研究室 池口満徳 教授、浴本 亨 助教らの研究グループは、細胞分裂前後の形質維持に関わるタンパク質UHRF1*1が、自身のリン酸化*2修飾によって、結合パートナーを制御する仕組みを構造生物学と計算科学を組み合わせた手法で明らかにしました。
本研究は、『Journal of Molecular Biology』に掲載されました。(6 月1日オンライン)
研究成果のポイント
〇 UHRF1の298番目のセリン残基のリン酸化修飾が細胞周期のG2/M期に起こることを同定した。
〇 リン酸化修飾によるUHRF1の構造変化と、それに伴う結合因子の制御機構を明らかにした。
研究の背景
受精卵から細胞分裂を繰り返した細胞は、やがて専門の働きを持つ細胞へと分化します。ヒトでは、分化した細胞の種類は約270種類あると言われています。これらの細胞は同じゲノム情報を持っていますが、細胞によって使う遺伝子が異なるために固有の形質を持ちます。この遺伝子の使われ方を制御する因子の一つがDNAメチル化*3です。哺乳類のDNAメチル化は一般的にCG配列中のシトシン塩基の5位の炭素に起こります。ヒトゲノム中には約3,000万ヵ所のCG配列が存在し、そのうち60~70%がメチル化されています。分化した細胞はその形質を保ったまま増殖しますが、これは細胞分裂後もDNAメチル化パターンが正確に受け継がれることで成し遂げられます。DNAメチル化が継承されていく仕組みを「DNA維持メチル化」と呼び、このプロセスの破綻は異常な遺伝子発現をもたらし、がんや精神疾患などの様々な病気との関連が報告されています。
DNA維持メチル化にはUHRF1と維持型DNAメチル化酵素DNMT1の2つのタンパク質が必須です。UHRF1はDNA複製後に生じた片鎖メチル化DNAを認識し、DNMT1を片鎖メチル化DNAに呼び込む役割をします。UHRF1は5つの機能ドメインからなり、そのうちのTTDドメイン*4 (以下UHRF1 TTD) は他の因子の結合の足場となる特徴的な「ペプチド結合溝」をもちます。この溝にはUHRF1分子内のリンカー領域であるlinker 2やspacer、9番目のリジンがトリメチル化されたヒストンH3*5 (H3K9me3) が結合します(図1)。
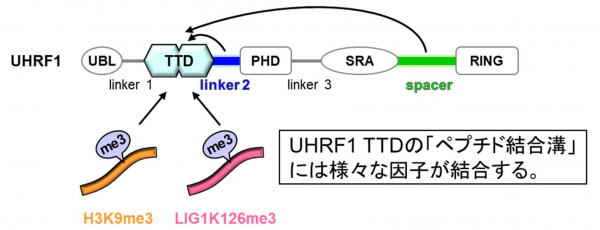
図1. UHRF1のドメイン構造
UHRF1 TTDは特徴的な「ペプチド結合溝」をもつ。UHRF1分子内のlinker 2やspacerとの分子内相互作用や、H3K9me3やLIG1K126me3と分子間相互作用し、結合の足場として働く。
本研究グループはまた、UHRF1 TTDの「ペプチド結合溝」に126番目のリジンがトリメチル化されたDNAリガーゼ1*6 (LIG1K126me3) が結合し、LIG1がUHRF1を複製部位に呼び込む働きを2019年3月に報告しています(
Structure 27, 485–496, March 5, 2019)。
これまでの研究で、これらの結合因子のうち、linker 2が優先的に「ペプチド結合溝」に結合すること、そしてlinker 2の領域内に存在するUHRF1の298番目のセリン残基(以下セリン298)のリン酸化によってその結合が弱くなることが明らかになっています。このことからUHRF1のセリン298のリン酸化が、他の結合因子が「ペプチド結合溝」に結合するスイッチの役割を果たすと考えられています。細胞周期依存的なUHRF1の翻訳後修飾はこれまでにいくつか報告されていますが、セリン298のリン酸化が起こる細胞周期のタイミングと、このリン酸化による適切な結合因子を選択する仕組みは不明でした。そこで本研究グループは、UHRF1のセリン298がリン酸化される時期の同定と、リン酸化UHRF1の構造変化の解析や結合因子との結合様式の解析を行うことにより、UHRF1のセリン298のリン酸化による結合因子の制御機構の解明に取り組みました。
研究の内容
セリン298がリン酸化されたUHRF1を特異的に認識する抗体を作製し、哺乳類細胞中でUHRF1のセリン298がいつリン酸化されるのかを調べました。その結果、細胞周期のG2(分裂準備)期からM(分裂)期にかけてセリン298がリン酸化されたUHRF1の量が増加することがわかりました。
次に、UHRF1 TTDドメインのみとUHRF1 TTDからlinker 2までの領域 (UHRF1 TTD-L2) のタンパク質を調製して等温滴定カロリメトリー*7で結合因子との相互作用を解析しました。その結果、spacerやH3K9me3はUHRF1 TTDドメインのみのタンパク質には結合しましたが、UHRF1 TTD-L2には結合できませんでした。しかし、この結合阻害はUHRF1 TTD-L2のセリン298がリン酸化されると解除されました。このことから、linker 2が「ペプチド結合溝」に優先的に結合しており、セリン298のリン酸化はlinker 2をペプチド結合溝から追い出すことが考えられました。本研究グループは、2019年3月の報告で、LIG1K126me3は、「ペプチド結合溝」に結合しているlinker 2を追い出すことでUHRF1 TTD-L2に結合できることを明らかにしました。しかし、その結合の強さはUHRF1 TTDとの結合に比べて約17倍弱く、セリン298のリン酸化によって結合の強さが回復することがわかりました。
さらに、セリン298のリン酸化がUHRF1の構造に与える影響を解析しました。X線溶液散乱測定*8の結果、リン酸化していないUHRF1 TTD-L2はUHRF1 TTDドメインのみと同等の大きさであるのに対し、セリン298をリン酸化したUHRF1 TTD-L2は分子の大きさが広がることがわかりました。また熱安定性実験からは、UHRF1 TTDドメイン単独の方が、UHRF1 TTD-L2よりも変性温度が低いことがわかりました。このことは、linker 2が「ペプチド結合溝」に入り込むとTTDの熱安定性が上がることを示しています。セリン298をリン酸化したUHRF1 TTD-L2の変性温度は、UHRF1 TTDドメイン単独とUHRF1 TTD-L2の中間を示しました。このことから、セリン298のリン酸化によってlinker 2が「ペプチド結合溝」から部分的に解離することが明らかになりました。
セリン298のリン酸化によって、linker 2が「ペプチド結合溝」から出ていく過程の詳細を明らかにするために、分子動力学シミュレーション*9を行いました。linker 2の「ペプチド結合溝」への結合には、「ペプチド結合溝」のアスパラギン酸142(D142)とlinker 2のアルギニン296(R296)の相互作用が重要です。S298をリン酸化したUHRF1 TTD-L2のシミュレーションの結果では、リン酸化セリン298(pS298)のリン酸基がこのアルギニン296と相互作用し、アスパラギン酸142とアルギニン296との間の相互作用を阻害することが明らかになりました(図2)。以上のことから、UHRF1は298番目のセリン残基のリン酸化によってlinker 2が「ペプチド結合溝」から部分的に解離した構造状態へと変化し、他の結合因子がアクセスできるようになるという分子機構を明らかにしました。
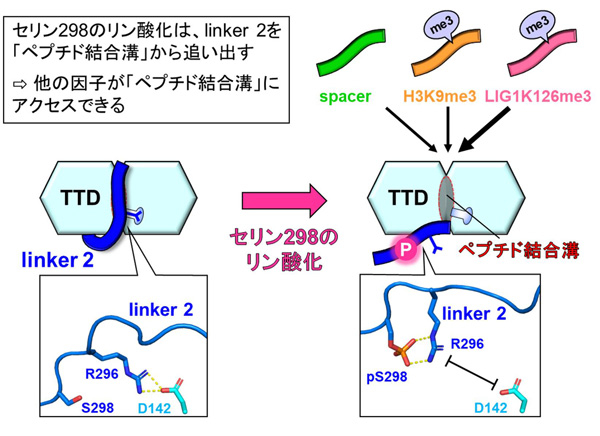
図2. セリン298のリン酸化によるUHRF1の構造変化
「ペプチド結合溝」に優先的に結合していたlinker 2が、セリン298のリン酸化によって解離し、他の結合因子がアクセスできる状態になる。
今後の展開
本研究成果は、DNA維持メチル化に関わるUHRF1と結合因子との結合が、セリン298のリン酸化修飾によって制御される分子機構を初めて解明しました。これは、UHRF1 TTDの「ペプチド結合溝」における複数の結合因子との結合とその制御の一端に関わる成果であり、翻訳後修飾を受けたUHRF1の機能を理解する重要な知見です。
また、セリン298のリン酸化が細胞周期のG2/M期で起こることを明らかにしました。非リン酸化体UHRF1は細胞周期のS(DNA合成)期でDNA合成に働くLIG1と結合して複製部位に呼び込まれ、一方で細胞周期M(分裂)期でリン酸化体UHRF1はH3K9me3との結合を介して染色体上に局在するなどの、細胞周期に応じた機能の使い分けがリン酸化で制御される可能性が考えられます。今後、哺乳類細胞を用いた機能解析などを行うことでUHRF1の298番目のセリン残基のリン酸化の生理学的機能の全容解明が期待されます。
用語説明
*1 UHRF1
DNA維持メチル化に必須なタンパク質。片鎖メチル化DNAの認識やH3K9me3との結合、ヒストンH3のユビキチン化修飾などの様々な機能を持つ。
*2 リン酸化
側鎖に水酸基を持つアミノ酸にリン酸基 (-PO42-) が付加される反応のことで、タンパク質に起こる翻訳後修飾の一つである。
*3 DNAメチル化
DNAのシトシン塩基の5位の炭素原子にメチル基 (-CH3) が付加される反応。ヒトでは主にCG配列中のシトシン塩基のみがメチル化される。メチル化されたDNAは遺伝子発現の抑制などに関与し、細胞の遺伝子発現パターンを決定する。
*4 TTDドメイン (UHRF1 TTD)
UHRF1の機能ドメインの一つ。Tudorドメインが2つ並んだ構造をとり、その間に結合因子の足場となる「ペプチド結合溝」が存在する。
*5 ヒストンH3
核内でDNAを収納するヌクレオソームを構成するヒストンタンパク質の一つ。ヒストンH3の9番目のリジンのトリメチル化は、ヌクレオソームが凝集したヘテロクロマチン構造の形成に促し、遺伝子発現の抑制に関与する。
*6 DNAリガーゼ1
DNA複製中に生じる短いDNA複製断片である岡崎フラグメントを連結するタンパク質。DNA複製部位に局在し、UHRF1を複製部位に呼び込む働きをする。
*7 等温滴定カロリメトリー
生体分子の結合に伴う熱量を計測し、相互作用を定量的に解析する手法。反応中の熱力学的パラメータを得ることができる。
*8 X線溶液散乱測定
溶液中のタンパク質にX線を照射し、得られた散乱強度データからタンパク質の慣性半径や最大長など、分子の形に関する情報を得る構造生物学的な研究手法。
*9 分子動力学シミュレーション
タンパク質を構成する原子について運動方程式を解くことで、タンパク質の動的な構造変化をコンピュータ上でシミュレーションする手法。
掲載論文
Serine 298 Phosphorylation in Linker 2 of UHRF1 Regulates Ligand-Binding Property of its Tandem Tudor Domain
Satomi Kori, Tomohiro Jimenji, Toru Ekimoto, Miwa Sato, Fumie Kusano, Takashi Oda, Motoko Unoki, Mitsunori Ikeguchi, Kyohei Arita
Journal of Molecular Biology (2020),
https://doi.org/10.1016/j.jmb.2020.05.006
※本研究は、JSPS科研費(JP18H02392, JP19H05294, JP19H05741, JP19J22030)、JSTさきがけ、武田科学振興財団、横浜市立大学戦略的研究推進事業などの助成を受けて行われました。
発表者
横浜市立大学 大学院生命医科学研究科 構造生物学准教授 有田恭平

