―うつ病を含む気分障害に対する新たな創薬標的を創出―
藤田医科大学(愛知県豊明市沓掛町田楽ヶ窪1番地98)精神・神経病態解明センターの貝淵弘三センター長、坪井大輔講師、永井拓教授、佐野准教授らを含む研究グループは、報酬学習を制御する細胞内シグナル伝達経路の一端を明らかにしました。
報酬に関する学習機構には意欲(“やる気”)を高める役割があると考えられています。例えば、テストで高得点を取った時に周りから褒められると、次のテストも頑張ろうと思ったようなことがありませんか。これはある行動(テストで高得点をとる)と報酬(褒められる)が関連付けられることで、その行動に対する意欲が生まれるからです。一方で、ストレスなど様々な要因で抑うつ状態(意欲減退)になってしまうと、報酬を知覚してもなかなか行動を起こす気になれないことがあります。
報酬シグナルの知覚・学習にはドーパミン(英語名:dopamine, DA) [注1]と呼ばれる神経伝達物質が関与していると考えられています。しかしながら、ドーパミンがどのように報酬学習を制御するかについては十分に分かっていませんでした。
同研究グループは、報酬行動や意欲を司る脳領域である側坐核[注2]の神経細胞においてドーパミン刺激によってリン酸化された電位依存性カリウムチャネルKCNQ2[注3]が神経細胞の興奮性[注4]を高め、報酬行動を促進させることをマウスを用いて明らかにしました。
本研究は、報酬学習におけるドーパミン-KCNQ2シグナル伝達経路の生理学的意義を解明するものであり、KCNQ2チャネルが快楽消失や意欲減退を徴候とするうつ病などの精神疾患に対して新たな治療標的となりえることが示されました。この研究成果は、国際自然科学誌「Cell Reports(セル・リポーツ)」(2022年9月6日付オンライン版)に掲載されました。
<研究成果のポイント>
- 神経伝達物質ドーパミンが関わる神経細胞の興奮メカニズムを明らかにしました。
- ドーパミン受容体作動薬による刺激は、神経細胞に存在するKCNQチャネルの外向きカリウム電流を抑制しました。
- 脳内ドーパミン濃度の上昇は、KCNQ2のリン酸化を亢進させました。
- KCNQ2のリン酸化が、カリウム電流を抑制し神経細胞の興奮性を高めることで報酬行動を促進することを明らかにしました。
<背 景>
脳深部に位置する側坐核は”やる気“を生み出す元となる報酬学習に重要な役割を果たしています。報酬刺激は側坐核に投射するドーパミン作動性神経からのドーパミン放出を促します。ドーパミンは側坐核の神経細胞の興奮性を高めることが知られていましたが、ドーパミンが関わる神経細胞の興奮性メカニズムについては十分に理解されていませんでした。
本研究グループは、これまでに実施したプロテオミクス解析からタイプ1ドーパミン受容体(D1R)の刺激でリン酸化が上昇する蛋白質を100種類以上同定していました (Nagai et al, Neuron, 89(3), 2016)。これらの蛋白質のリン酸化情報は、同グループが開発したリン酸化情報データベースKANPHOS (Kinase-Associated Neural Phospho-Signaling database)(
https://kanphos.neuroinf.jp )に系統的に登録されています。KANPHOSデータベースは、神経伝達物質のリン酸化シグナルと外部データを包括的に解析できると共に、ワンショットで関連する細胞内シグナル伝達経路や疾患、薬剤、ゲノム、モデル動物との関連解析ができるリン酸化情報基盤プラットフォームです(Ahammad et al, Cells, 11(1), 2021)。KANPHOSのパスウェイ解析を活用しD1Rシグナル伝達経路を絞り込むことで、ドーパミンがPKA/Rap1/ERK経路を介してD1R発現型の中型有棘神経細胞(D1R-MSN)の興奮性と発火率を高め、報酬行動を促進させることを見出していました (Nagai et al., Neuron, 89(3), 2016)。しかしながら、ERKがどのようにD1R-MSNの興奮性を高めるかについては明らかになっていませんでした。
<研究成果>
本研究グループはKANPHOSを用いた細胞内シグナル伝達経路解析から、ERKの下流シグナル伝達分子としてカリウムチャネルKCNQを同定しました (Nagai et al, Trends Pharmacol Sci, 37(10), 2016)。また、マウスの側坐核スライスを用いた薬理学的解析から、研究グループはD1R作動薬であるSKF81297がKCNQチャネル依存性の電流を抑制することで、D1R-MSNの発火率が増加することを見出しました。SKF81297刺激による電流抑制にはERK活性が必要であることも明らかにしました。生化学的解析から、ERKがKCNQ2のSer414とSer476を直接リン酸化すること、これらのリン酸化部位欠損KCNQ2変異体ではERKによるKCNQ依存性電流の抑制効果が消失していることを見出しました。D1R-MSN特異的にKCNQ2が欠損したKcnq2のコンディショナルノックアウトマウス(Kcnq2-cKO)の行動学的解析では、神経細胞の興奮性とコカイン誘発性の報酬行動が増強することが分かりました。Kcnq2-cKOマウスで観察された増強効果はリン酸化部位欠損KCNQ2ではなく野生型KCNQ2を補充することで消失しました。以上の解析から、ドーパミンで惹起されたERKの活性化が、KCNQ2のリン酸化修飾を介して自身のチャネル活性を負に制御することで、神経細胞の興奮性を増大させることを明らかにしました。
<解説図解>
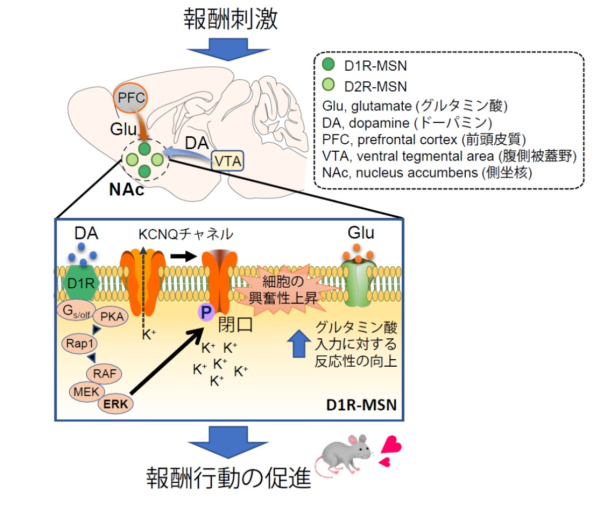
上図:報酬行動を促進させる神経細胞の興奮メカニズム
線条体およびその腹側の側坐核を含む神経核は、報酬行動において重要な役割を担っています。線条体/側坐核は主に中型有棘神経細胞(MSN)で構成されており、MSNはタイプ1ドーパミン受容体(D1R)を発現する神経細胞(D1R-MSN)とタイプ2ドーパミン受容体(D2R)を発現する細胞(D2R-MSN)に分けられます。報酬行動においては、前頭皮質(PFC)から投射されるグルタミン酸作動性入力と腹側被蓋野(VTA)から投射されるドーパミン作動性入力の協調的な刺激により、D1R-MSNの強い興奮が引き起こされます。本研究では、ERKがKCNQ2のリン酸化修飾を介して自身の構成チャネル活性を負に制御することで、神経細胞の興奮性を増大させることを明らかにしました。
<今後の展開>
うつ病を含む気分障害では、脳内報酬系回路の機能不全を伴う徴候(意欲減退や快楽喪失)が多く認められます。うつ病の治療には抗うつ薬の持続的投与が有効であると示唆されているものの、治療抵抗性や断薬後の再発など多くの課題を抱えています。これらの課題を克服するには気分障害の分子レベルでの病態の解明が必要不可欠です。本研究成果により報酬学習にドーパミン-KCNQ2シグナル伝達経路が関与することが明らかになりました。本シグナル伝達経路やKCNQチャネルの活性を調節する薬物が、うつ病を含む気分障害に対して治療候補薬となることが期待されます。
また、コカインのような精神刺激薬は強い薬物依存性を持ち、薬物乱用は大きな社会問題のひとつとなっています。ドーパミン-KCNQ2シグナル伝達経路は薬物による強迫的欲求にも関与している可能性があり、同経路の制御が薬物依存症に対する新たな治療戦略となることも期待されます。
<用語解説>
(注1) ドーパミン
ドーパミン(英語名:dopamine, DA)はモノアミン系の神経伝達物質であり、中枢神経系で高く発現しています。ドーパミンは運動調節やホルモン調節、情動、意思決定、学習を制御することが知られています。
(注2) 側坐核
側坐核は皮質下脳領域の一つであり、情動(報酬、快楽、嗜好、恐怖)や意思決定を司る領域です。側坐核を構成する神経細胞の大部分は抑制性の神経細胞であり、その抑制作用により脳幹部の活動を制御することで、適切な行動発現を調節しています。さらに側坐核神経は発現するドーパミン受容体の違いから、2種類の神経サブタイプがあります。一つはタイプ1 ドーパミン受容体(dopamine type-1 receptor, D1R)を発現する神経細胞で、もう一方はタイプ2 ドーパミン受容体(dopamine type-2 receptor, D2R)を発現する細胞です。これらのサブタイプ神経は異なるシグナル伝達経路を制御しています。
(注3) KCNQ2
KCNQ2はKCNQ/Kv7 ファミリーに属する電位依存性カリウムチャネルのサブユニットであり、主に外向きのカリウム電流を制御しています。本サブユニットは電圧や翻訳後修飾、蛋白質間相互作用などの様々な刺激により開口調節されることが知られています。ヒトゲノム上では、5 つのアイソフォーム(KCNQ1~KCNQ5)がコードされています。中枢神経系では、主にKCNQ2とKCNQ3サブユニットからなるKCNQヘテロチャネルが反復性の神経発火や活動電位の閾値などを制御しています。
(注4) 神経細胞の興奮性
細胞膜の内外には電解質が不均衡に分布しており、神経細胞の細胞膜は刺激に応じて細胞内外の電解質が大きく変化することで多様な膜電位をとります。膜電位が閾値を超えると活動電位が発生し細胞が興奮します。
<文献情報>
雑誌名
Cell Reports
論文タイトル
Dopamine drives neuronal excitability via KCNQ channel phosphorylation for reward behavior
著者
坪井大輔1, 大塚岳2, 下村拓史3, Md. Omar Faruk6, 山橋幸恵1, 天野睦紀6, 船橋靖広1, 黒田啓介6, 西岡朋生1, 小林憲太4, 佐野裕美1,5, 永井拓1, 山田清文7, Anastasios V Tzingounis8, 南部篤5, 久保義弘3, 川口泰雄2,9, 貝淵弘三1,3
所属
1 藤田医科大学 精神・神経病態解明センター
2 生理学研究所 時系列細胞現象解析室
3 生理学研究所 神経機能素子研究部門
4 生理学研究所 ウイルスベクター開発室
5 生理学研究所 生体システム研究部門
6 名古屋大学大学院 医学系研究科 神経情報薬理学
7 名古屋大学大学院 医学系研究科 医療薬学
8 米国 コネティカット大学 神経生理学
9 玉川大学 脳科学研究所
DOI
10.1016/j.celrep.2022.111309